Alternde Barrieren und endotheliale Seneszenz
Wie wirkt sich das Altern der Endothelzellen auf deren Funktion in verschiedenen Organen bei Alter und Krankheit aus?
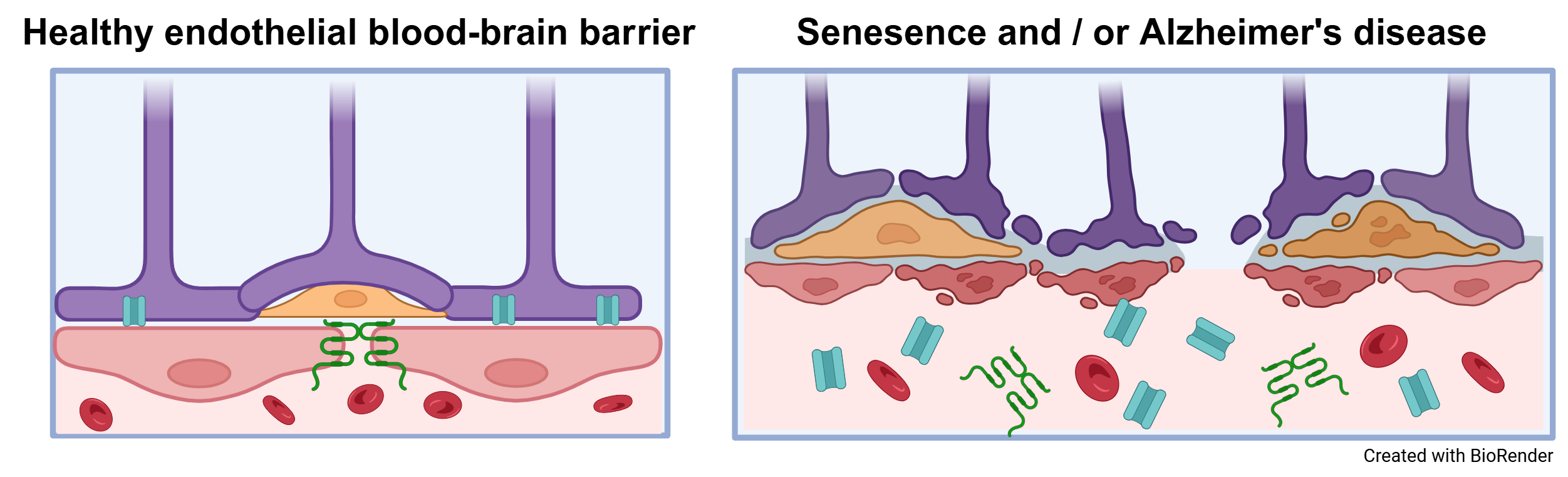
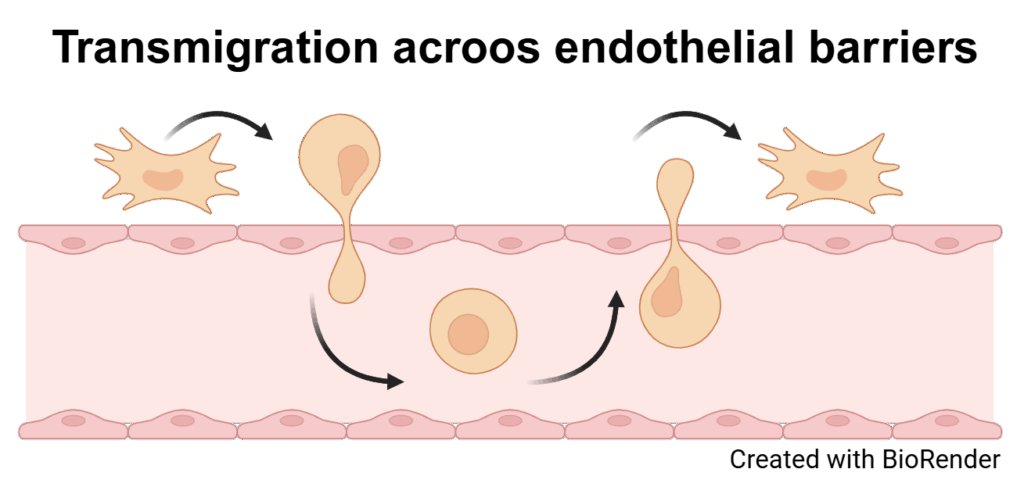
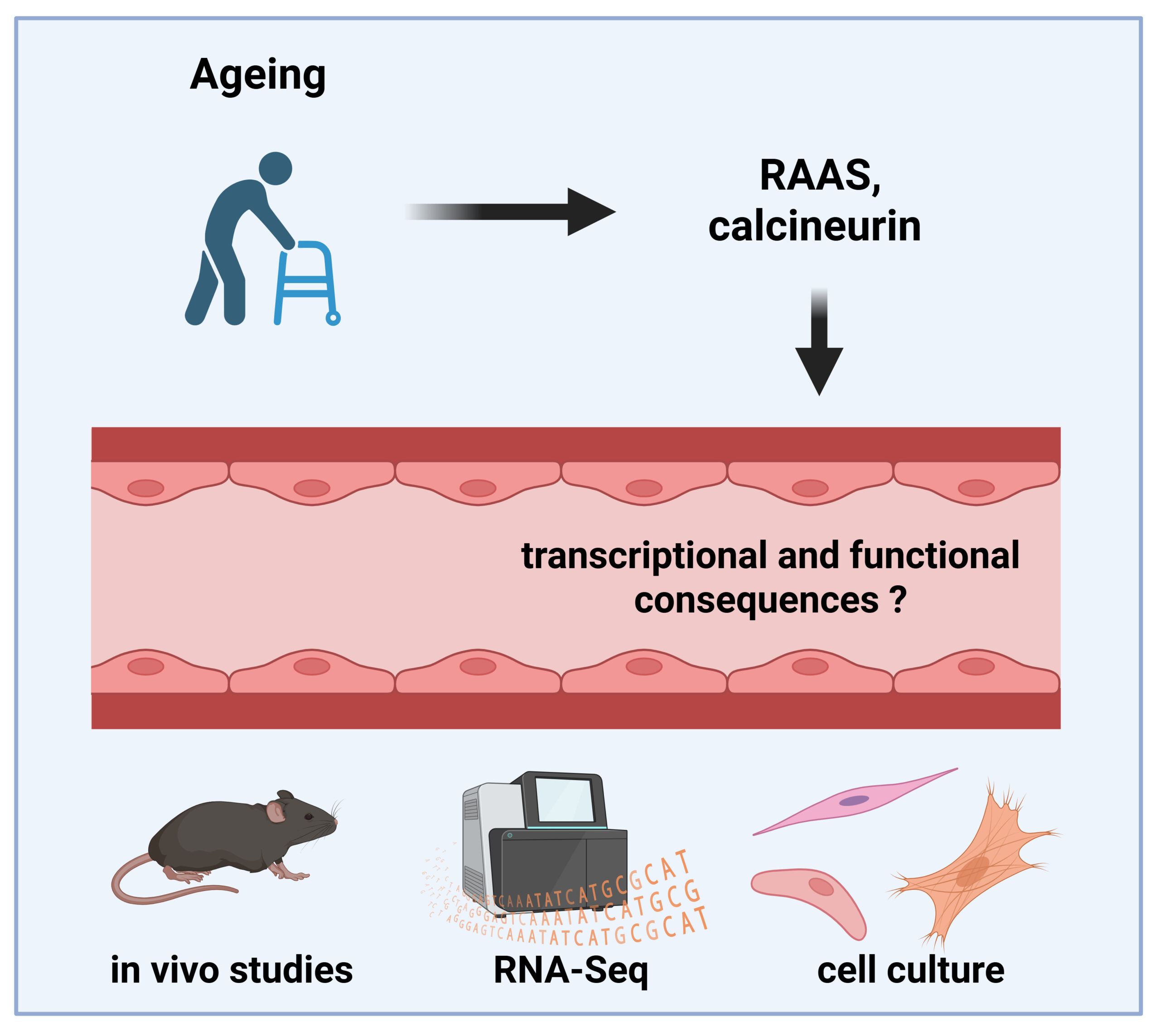
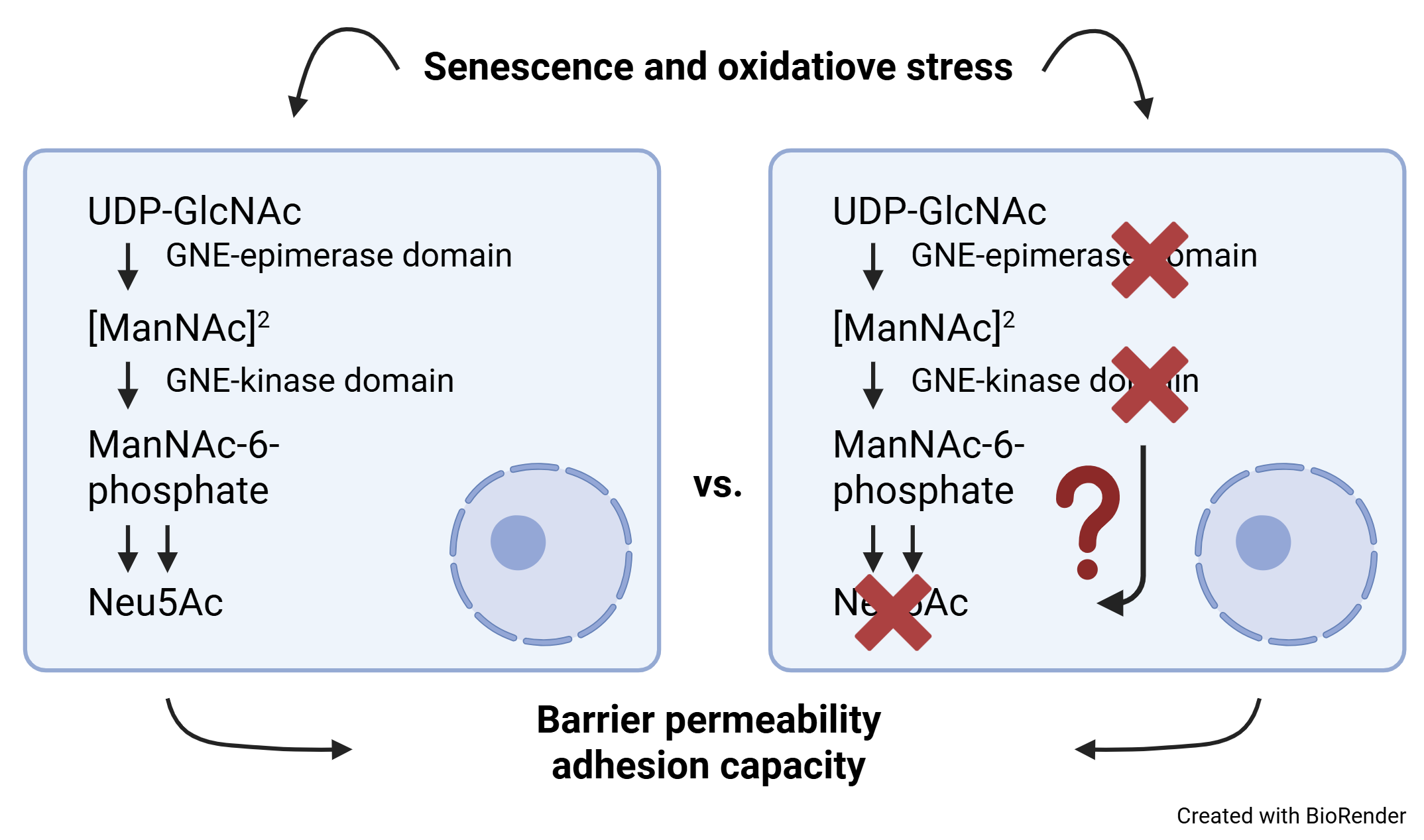
Endothelzellen sind besondere Zellen, die wichtige Schutzbarrieren zwischen unseren Organen und dem Blutkreislauf bilden. Diese Barrieren entscheiden, welche Stoffe ins Organ gelangen und welche draußen bleiben oder herausgeschleust werden. Das ist zum Beispiel wichtig, damit das Gehirn vor giftigen Stoffen geschützt bleibt. Wenn wir älter werden oder krank sind, funktionieren diese Schutzwände oft schlechter. Ein Grund dafür ist, dass manche Zellen im Alter oder bei Krankheiten aufhören, sich zu teilen – das nennt man „zelluläre Seneszenz“. Bisher wissen Forscherinnen und Forscher noch nicht genau, wie dieses Altern der Zellen die Schutzfunktionen beeinflusst, zum Beispiel an der Blut-Hirn-Schranke oder in anderen Gefäßen. Die Wissenschaftlerinnen und Wissenschaftler an der Martin-Luther-Universität Halle-Wittenberg wollen das in einem großen Projekt besser verstehen. Sie schauen sich dazu Zellen von jungen und alten Menschen an, verwenden moderne Labormodelle mit menschlichen Stammzellen und arbeiten auch mit Tieren, um die Unterschiede im gesunden und im alten oder kranken Zustand zu vergleichen. Besonders wichtig ist dabei ein bestimmtes Zuckermolekül, Sialinsäure genannt, das den Schutz der Barrieren mitbestimmt. Außerdem nehmen sie Blutproben von Menschen mit Demenz, um nach Alterszeichen zu suchen, die eventuell helfen könnten, Krankheiten besser zu erkennen oder zu behandeln. In dem Projekt arbeiten viele Forscherinnen und Forscher aus der Medizin und den Naturwissenschaften zusammen, um gemeinsam mehr über das Altern, Krankheiten und den Schutz der Organe zu lernen und später vielleicht neue Therapien zu entwickeln.
Projektbeschreibungen
Mitglieder
Dr. rer. nat.
Matthias Jung
Sprecher & SP 2 – PI
Physiologische Chemie, UMH
Dr. med.
Annemarie Thäle
SP 1 – PI
Neurologie, UMH
Dr. troph.
Juliane-Susanne Jung
SP 5 – PI
Anatomie & Zellbiologie, UMH
Prof. Dr. med.
Markus Otto
SP 1 – Co-PI
Neurologie, UMH
Dr. rer. nat.
Kaya Bork
SP 4 – Co-PI
Physiologische Chemie, UMH
Prof. Dr. nat.
Thomas Hollemann
SP 2 – Co-PI
Physiologische Chemie, UMH
Prof. Dr. med. Dr. rer. nat.
Claudia Grossmann
SP 3 – PI
Julius-Bernstein-Institut, UMH
Dr. rer. nat.
Astrid Gesper
SP 4 – PI
Physiologische Chemie, UMH